文章信息
- 杨海君, 王巧, 万自学, 张正云, 陈丹丹, 谭菊. 2021.
- YANG Haijun, WANG Qiao, WAN Zixue, ZHANG Zhengyun, CHEN Dandan, TAN Ju. 2021.
- 入侵地加拿大一枝黄花根际和非根际土壤微生物群落结构及多样性
- Structure and diversity of microbial communities in the rhizosphere and non-rhizosphere soil in areas with invasive Solidago canadensis L.
- 生物安全学报, 30(4): 235-243
- Journal of Biosafety, 30(4): 235-243.
- http://dx.doi.org/10.3969/j.issn.2095-1787.2021.04.001
文章历史
-
收稿日期(Received): 2021-05-16
接受日期(Accepted): 2021-09-02
2. 湖南农业大学资源环境学院, 湖南 长沙 410128;
3. 湖南省长沙生态环境监测中心, 湖南 长沙 410014
2. School of Resources and Environment, Hunan Agricultural University, Changsha, Hunan 410128, China;
3. Changsha Ecological Environment Monitoring Center of Hunan Province, Changsha, Hunan 410014, China
随着全球贸易的快速发展、气温变暖以及旅游和交通的发展,外来植物入侵的趋势不断加剧,入侵植物对入侵地的生态环境、社会经济、生态安全和人类健康产生了严重影响,遏制外来植物入侵已成为亟待解决的难题(许光耀等,2018)。外来植物成功入侵新生境主要是由于自身具有较强的入侵力和新栖息地具有较高的可侵入性(何锦峰,2008)。解释外来植物成功入侵主要有天敌逃避假说(Wolfe,2002)、资源可获得性假说(Davis et al., 2000)、生态位机会假说(Shea & Chesson, 2002)、多样性抵抗假说(Kennedy et al., 2002)等。随着对外来植物入侵的机理及生态学过程的深入研究,部分研究者发现,土壤微生物对外来植物的成功入侵发挥着重要作用,外来植物引起的“入侵灾难”是由土壤微生物介导的(Zhang et al., 2020)。外来入侵植物与土壤微生物关系的研究日益得到的重视(管铭等,2015;彭鑫怡等,2019)。近年来,土壤微生物在外来植物入侵过程中的作用越来越受到重视。入侵植物与根际微生物之间有着显著的关联性,一方面,植物入侵到新的栖息地后能够促进其根际土壤微生物群落结构的演替、改变土壤理化性质、强化微生物群落功能的发挥、创造适合自身生长发育的土壤微环境,进而加快入侵进程(王桔红等,2016)。如互花米草Spartina aalterniflora Loisel.、紫茎泽兰Eupatorium adenophora Spreng.、空心莲子草Alternanthera Philoxeroides (Mart.) Griseb.、豚草Ambrosia artemisiifolia L.等入侵新生境后,土壤微生物群落结构和多样性均发生了改变,进而影响了植物对养分的吸收以及土壤的营养循环和能量流动(柳旭等,2019;孙建茹等,2019;王志勇等,2013;郑洁等,2017)。另一方面,根际微生物可协助植物吸收和利用土壤养分,促进植物生长,提高抗逆性,使植物免受致病菌侵害(黄芳芳等,2020)。研究发现,丛枝菌根真菌可显著提高入侵植物的生长和对养分的吸收、增强对本地植物的竞争能力、加速入侵植物的扩张进程(李立青等,2016;祁珊珊等,2020;张玉曼等,2015)。如小蓬草Erigeron canadensis L.、紫茎泽兰和黄顶菊Flaveria bidenti (L.) Kuntze等入侵新生境后,根际益生菌群落明显占据优势地位,在一定程度上能够帮助宿主适应各种环境(程丹丹等,2019;柳旭等,2019;赵晓红等,2014)。
加拿大一枝黄花Solidago canadensis L.属菊科一枝黄花属,多年生草本植物,原产于加拿大和美国,1935年作为观赏植物引种到我国,后逸生成为恶性杂草,并于2010年被列入中国重要外来有害植物名录(上海科学院,1999)。研究人员通过对加拿大一枝黄花的快速入侵、定殖与机理的研究发现,其成功入侵定殖与根际微生物关系密切,但尚未全面、深入探究其根际和非根际土壤微生物的群落特征。陈晨等(2009)对加拿大一枝黄花根际部分可培养细菌进行了多样性分析,但未揭示根际和非根际土壤微生物群落之间的差异。基于此,本研究应用高通量测序技术研究加拿大一枝黄花根际和非根际土壤微生物群落结构及其微生物区系结构上的差异,分析加拿大一枝黄花成功入侵与根际土壤微生物群落结构的关联性,揭示加拿大一枝黄花对入侵地土壤微生物多样性的影响,以期为加拿大一枝黄花的入侵机制和生态防治研究提供参考。
1 材料与方法 1.1 研究区概况土壤样品采自湖南省长沙市黄花镇郭公渡(28°16′N,113°12′E)。试验地属亚热带季风性气候,年平均温度16.8~17.2 ℃,最高温度40.6 ℃,最低温度-12 ℃。样地为加拿大一枝黄花严重危害地块,为害时间9~10年。样地上加拿大一枝黄花为单一种群,样方中加拿大一枝黄花密度62株·m-2,零星伴生有狗尾草Setaria viridis (L.) Beauv.和空心莲子草。
1.2 样品采集2021年1月17日,在研究区采集根际和非根际土壤。随机选取与入侵地块相距20 m的3 m×3 m样方5个,采用5点采样法在每个样方内采集5个子样本,将5个子样本混合在一起作为该样方内的土壤样本,以降低土壤异质性的干扰(侯乾,2020)。在采集加拿大一枝黄花根际土壤样品时,先清除伴生植物,再挖取整株加拿大一枝黄花,揉捏加拿大一枝黄花茎秆,拍打掉大块土壤,轻摇根部,抖落土壤后,用灭菌的刷子轻刷黏附在加拿大一枝黄花根表面的土壤,即为每个子样本的根际土壤,每个样方采集的5个子样本的根际土壤充分混匀则为1个样方的根际土壤样品,5个样方采集的根际土壤充分混匀则为1个根际土壤样品。以加拿大一枝黄花根系周围20 cm左右的混合土壤作为非根际土壤,采集根际土壤时一并采集非根际土壤,将5个样方非根际土壤充分混匀则为1个非根际土壤样品。根际土壤样品和非根际土壤样品各分2份,用无菌自封袋封装,一份用于土壤理化性质测定,一份置于冷却箱中(温度4 ℃),并立即转移到实验室-80 ℃超低温冰箱,备用。
1.3 土壤理化性质测定土壤pH值采用电位法测定(中国科学院南京土壤研究所,1978);土壤含水量采用烘干法测定(鲁如坤,2000);土壤有机质含量采用直接电位滴定法测定(周天阳等,2018)。
1.4 土壤微生物高通量测序将-80 ℃下保存的根际和非根际土壤样品于超净工作台中用1.5 mL离心管进行分装,根际和非根际土壤分别设土壤细菌和真菌样品2个处理,每个处理3个重复,共12个土壤样品。加拿大一枝黄花根际土壤细菌样品编号为R1(RB1、RB2、RB3),非根际土壤细菌样品编号为N1(NRB1、NRB2、NRB3);根际土壤真菌样品编号为R2(RF1、RF2、RF3),非根际土壤真菌样品为N2(NRF1、NRF2、NRF3)。将土壤样品送至北京诺禾致源科技股份有限公司进行土壤微生物高通量测序。使用515F 5′-GTGCCAGCCGGTAA-3′和907R 5′-CCGTCAATTCTTRACTTT-3′对16S rRNA基因V4区进行PCR扩增。将同一样本的PCR产物混合后使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences, Union City, CA, USA)进行回收产物纯化,2%琼脂糖凝胶电泳检测,并用QuantusTM Fluorometer(Promega,USA)对回收产物进行检测、定量。使用NEXTFLEX Rapid DNA-Seq Kit进行建库。利用Illumina公司的MiSeq PE300平台进行测序。
1.5 数据分析使用Qiime软件(Version 1.9.1)计算Alpha多样性指数,用R软件(Version 2.15.3)绘制稀释曲线和PCA图,并进行Alpha多样性指数组间差异和Beta多样性指数组间差异分析。采用Excel 2010与SPSS 21.0进行数据处理,利用Origin 8.0进行数据分析和制图。
2 结果与分析 2.1 土壤理化性质经测定,加拿大一枝黄花根际土壤的含水量、有机质含量、pH值分别为26.44%、6.63%、5.47;非根际土壤的含水量、有机质含量、pH值分别为23.74%、5.36%、5.62。二者间的土壤含水量差异显著(P<0.05),非根际土壤的有机质含量显著低于根际土壤(P<0.05),这主要是由于加拿大一枝黄花的入侵增加了生境中土壤有机质含量(陆建忠等,2005),其根际土壤和非根际土壤微生物群落之间的差异,造成了土壤有机质累积和消耗的速率不同。二者的土壤pH值无显著性差异(P>0.05),但根际土壤的pH值低于非根际土壤,这可能是加拿大一枝黄花根系分泌物对土壤性质的调节所致,表明加拿大一枝黄花的入侵改变了土壤pH值,以创造有利于其入侵的土壤环境(梁雷等,2016)。陆建忠等(2005)研究发现,野外加拿大一枝黄花入侵地pH值低于裸地,有机质含量则高于裸地,这表明,加拿大一枝黄花能够调节土壤的pH值和有机质含量,本研究结果与其研究结果趋于一致。
2.2 土壤微生物样品测序结果入侵地加拿大一枝黄花根际土壤和非根际土壤采用Illumina MiSeq测序后,共得到12个样本序列数据。根际土壤细菌共得到原始序列299812条,经拼接、质控后得到有效序列189753条,平均序列长度为415 bp;根际土壤真菌共得到原始序列314892条,经拼接、质控后得到有效序列201418条,平均序列长度为339 bp。非根际土壤细菌共得到原始序列291587条,经拼接、质控后得到有效序列182610条,平均序列长度为414 bp;非根际土壤真菌共得到原始序列303830条,经拼接、质控后得到有效序列187380条,平均序列长度为336 bp。从样品稀释曲线(图 1)看,随根际土壤和非根际土壤测序数量的增加,细菌和真菌的稀释曲线斜率均逐渐降低,曲线逐渐趋向平坦,说明测序数据量较为合理,更多的数据量仅产生少量新的物种。
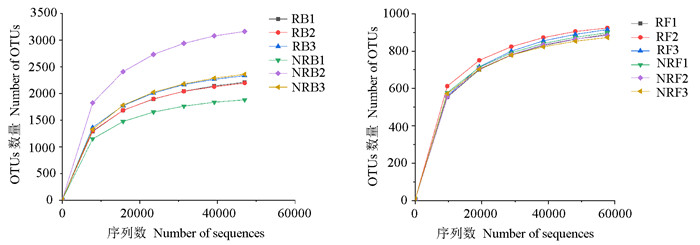
|
图 1 土壤样品稀释曲线
Fig.1 Dilution curves of the soil samples
RB1、RB2、RB3和NRB1、NRB2、NRB3分别为根际和非根际土壤细菌样品; RF1、RF2、RF3和NRF1、NRF2、NRF3分别为根际和非根际土壤真菌样品。 RB1, RB2, RB3 and NRB1, NRB2, NRB3 were rhizosphere and non-rhizosphere soil bacteria samples, respectively. RF1, RF2, RF3 and NRF1, NRF2, NRF3 were rhizosphere and non-rhizosphere soil fungi samples, respectively. |
从表 1可知,R1的Shannon指数(9.0650)和Simpson指数(0.9950)均大于N1的Shannon指数(9.0020)和Simpson指数(0.9940),表明根际土壤细菌的群落多样性高于非根际土壤细菌的群落多样性。R1的Chao1指数(2423.5000)和ACE指数(2445.3670)均小于N1的Chao1指数(2599.9600)和ACE指数(2642.4850),这表明根际土壤细菌的丰度低于非根际土壤细菌的丰度。但二者间的群落多样性和丰度无显著差异(P>0.05)。R2的Shannon指数(6.0130)和Simpson指数(0.9320)均小于N2的Shannon指数(6.3960)和Simpson指数(0.9580),表明根际土壤真菌的群落多样性低于非根际土壤真菌的群落多样性,R2的Chao1指数(963.3600)和ACE指数(972.5100)均大于N2的Chao1指数(924.7300)和ACE指数(937.3210),这表明根际土壤真菌的丰度高于非根际土壤真菌的丰度。但二者间的群落多样性和丰度无显著差异(P>0.05)。根际土壤和非根际土壤中,土壤细菌的Shannon指数、Simpson指数、Chao1指数、ACE指数均高于真菌,说明土壤样品中细菌的群落多样性和丰度均高于真菌。所有样品的覆盖率均大于0.95,说明样品的序列基本上都已被检出,表明测序结果可反映检测样品的真实情况。
| 样品Sample | Shannon指数Shannon index | Simpson指数Simpson index | Chao1指数Chao1 index | ACE指数ACE index | 覆盖率Coverage/% |
| R1 | 9.0650±0.0890 | 0.9950±0.0005 | 2423.5000±57.7400 | 2445.3670±60.7410 | 0.9930±0.0000 |
| N1 | 9.0020±0.5170 | 0.9940±0.0020 | 2599.9600±519.6000 | 2642.4850±558.6470 | 0.9930±0.0010 |
| P值P value | 0.8753 | 0.2524 | 0.6581 | 0.6459 | 1.000 |
| R2 | 6.0130±0.4760 | 0.9320±0.0300 | 963.3600±12.5870 | 972.5100±14.1500 | 0.9980±0.0000 |
| N2 | 6.3960±0.1360 | 0.9580±0.0080 | 924.7300±25.9450 | 937.3210±20.5370 | 0.9980±0.0004 |
| P值P value | 0.3355 | 0.3053 | 0.1311 | 0.1167 | 0.3739 |
| R1、N1分别为根际和非根际细菌样品,R2、N2分别为根际和非根际真菌样品。 R1 and N1 were rhizosphere and non-rhizosphere bacteria samples, R2 and N2 were rhizosphere and non-rhizosphere fungi samples, respectively. | |||||
由图 2可知,加拿大一枝黄花根际和非根际土壤样品共获得的细菌OTUs数为5313个,它们共有的OTUs数量为1851,非根际土壤细菌特有的OTUs数量比根际土壤细菌特有的OTU数量多,说明非根际土壤的细菌种类较多。两个样品共获得的真菌OTUs数为1444个,它们共有的OTUs数量(1029)明显高于其特有的OTUs数,说明根际和非根际真菌组成相似性较高。
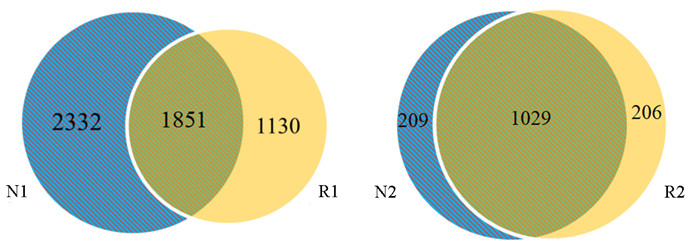
|
图 2 加拿大一枝黄花根际和非根际土壤韦恩图 Fig.2 The OTUs Venn map of rhizosphere and non-rhizosphere soil of S. canadensis R1、N1分别为根际和非根际细菌样品,R2、N2分别为根际和非根际真菌样品。 R1 and N1 were rhizosphere and non-rhizosphere bacteria samples, R2 and N2 were rhizosphere and non-rhizosphere fungi samples, respectively. |
根据物种注释结果,选取加拿大一枝黄花根际和非根际土壤微生物在门水平上最大丰度排名前10的物种,生成物种相对丰度柱形累加图(图 3)。由图 3可知,在门水平上根际和非根际土壤样品的优势细菌均为酸杆菌门Acidobacteriota和变形菌门Proteobacteria,两者的细菌总相对丰度在根际和非根际土中分别为42.92%和34.23%。根际土壤样品优势真菌为子囊菌门Ascomycota、被孢霉门Mortierellomycota和担子菌门Basidiomycota,非根际土壤样品优势真菌为子囊菌门Ascomycota、担子菌门Basidiomycota和球囊菌门Glomeromycota。其中,子囊菌门Ascomycota为根际土壤和非根际土壤中相对丰度最高的优势真菌,占比分别为58.6%和57.3%。整体来说,加拿大一枝黄花根际土壤样品中的优势微生物相对丰度大于非根际土壤。加拿大一枝黄花根际和非根际微生物优势菌物种丰度在门的水平上有着明显的差异,说明加拿大一枝黄花入侵对根际微生物群落结构有一定的影响和调节作用。
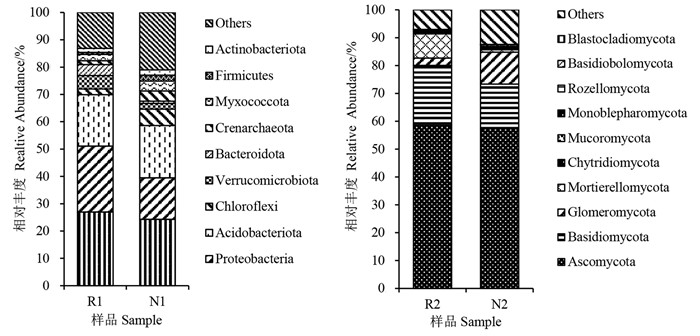
|
图 3 加拿大一枝黄花根际和非根际土壤微生物群落在门分类水平的组成和相对丰度 Fig.3 Composition and relative abundance of soil microbial communities in rhizosphere and non-rhizosphere of S. canadensis at phylum level R1、N1分别为根际和非根际细菌样品,R2、N2分别为根际和非根际真菌样品。 R1 and N1 were rhizosphere and non-rhizosphere bacteria samples, R2 and N2 were rhizosphere and non-rhizosphere fungi samples, respectively. |
由图 4可知,在加拿大一枝黄花根际土壤和非根际土壤细菌中,太阳念珠菌属Candidatus Solibacter的相对丰度均为最高,分别为3.9%、2.1%。各菌属的相对丰度都存在着明显的差异,根际土壤中太阳念珠菌属、Ellin6067、伯克氏菌属Burkholderia-Caballeronia-Paraburkholderia和慢生根瘤菌属Bradyrhizobium的相对丰度明显高于非根际土壤,而不动杆菌属Acinetobacter的相对丰度显著低于非根际土壤。根际土壤真菌中的小画线壳属Monographella、鬼笔属Phallus、被孢霉属Mortierella、镰刀菌属Fusarium、斜盖伞属Clitopilus的相对丰度分别为20.2%、10.0%、8.6%、5.8%、4.8%,均明显高于非根际土壤,而Sistotrema、unidentified_Ascomycota _sp、unidentified_Paraglomerales _ sp、茶渍属Lecanora的相对丰度明显低于非根际土壤,占根际土壤真菌的比例分别为0.6%、2.0%、0.4%、1.2%。这说明加拿大一枝黄花根际和非根际土壤真菌物种种类和丰度在属的水平上都有较大的差距,优势菌群也互不相同。
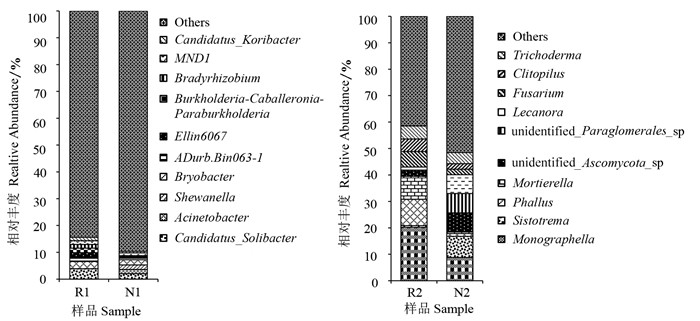
|
图 4 加拿大一枝黄花根际和非根际土壤微生物群落在属分类水平的组成和相对丰度 Fig.4 Composition and relative abundance of soil microbial communities in rhizosphere and non-rhizosphere of S. canadensis at genus level R1、N1分别为根际和非根际细菌样品,R2、N2分别为根际和非根际真菌样品。 R1 and N1 were rhizosphere and non-rhizosphere bacteria samples, R2 and N2 were rhizosphere and non-rhizosphere fungi samples, respectively. |
根据土壤样品在属水平的物种注释及丰度信息,选取丰度排名前35的属,进行物种和样品的聚类分析,结果如图 5所示。组内样品3个重复均聚类在一起,说明重复性较好。由组间样品聚类分析可知,根际土壤细菌群落中优势菌属主要集中于鞘氨醇单胞菌属Sphingomonas、Haliangium、MND1等23个属,而非根际土壤的优势菌属主要集中于Erysipelatoclostridium、假单胞菌属Pseudomonas、不动细菌属Acinetobacter等12个属,其中根际土壤中Massilia、苯丙叶杆菌属Phenylobacterium、Candidatus Nitrosotalea、科巴菌属Candidatus Koribacter等属的相对丰度显著高于非根际土壤,Erysipelatoclostridium、Dongia、RB41、假单胞菌属Pseudomonas、不动细菌属等属的相对丰度显著低于非根际土壤,说明根际和非根际土壤细菌群落差异较大。根际土壤优势菌属主要集中于Paraglomus、Mortieralla、肱骨菌属Humiccla等14属,而非根际土壤真菌优势菌属主要集中于Crassiparies、树粉孢属Oidiodendron、Lecanora等21个属,说明根际和非根际土壤真菌群落也有着较大的差异。
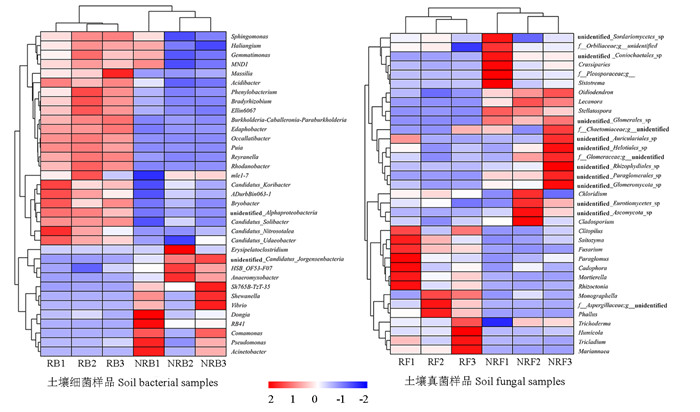
|
图 5 加拿大一枝黄花根际和非根际土壤微生物群落聚类热图
Fig.5 Cluster heat map of rhizosphere and non-rhizosphere soil microbial communities of S. canadensis
RB1、RB2、RB3和NRB1、NRB2、NRB3分别为根际和非根际土壤细菌样品; RF1、RF2、RF3和NRF1、NRF2、NRF3分别为根际和非根际土壤真菌样品。 RB1, RB2, RB3 and NRB1, NRB2, NRB3 were rhizosphere and non-rhizosphere soil bacteria samples, respectively. RF1, RF2, RF3 and NRF1, NRF2, NRF3 were rhizosphere and non-rhizosphere soil fungi samples, respectively. |
PCA分析可以直观地反映土壤样品间的差异性或相似性。由图 6可知,细菌群落组成PCA分析结果中主成分1和主成分2的贡献率分别为43.36%和25.43%。加拿大一枝黄花根际土壤细菌群落之间的距离比较近,说明它们的群落组成比较相似,而非根际土壤细菌群落较为分散,说明它们的群落组成差异较大,群落相似性低。从组间对比可知,R1和N1群落分布距离相差较大,说明加拿大一枝黄花根际和非根际土壤细菌群落组成存在较大的差异。真菌群落组成PCA分析结果中主成分1和主成分2的贡献率分别为31.18%和19.16%。加拿大一枝黄花根际和非根际土壤真菌群落组内分布都较为分散,组间的差异性较大,说明根际和非根际土壤真菌群落组成有很大的不同。所以,无论是细菌群落结构还是真菌群落结构,加拿大一枝黄花根际和非根际土壤都存在较大的差异。这可能是由于加拿大一枝黄花通过根系活动改变了根际土壤的理化性质等,从而改变根际微生物群落的组成,使得根际和非根际土壤微生物组成和多样性存在差异。
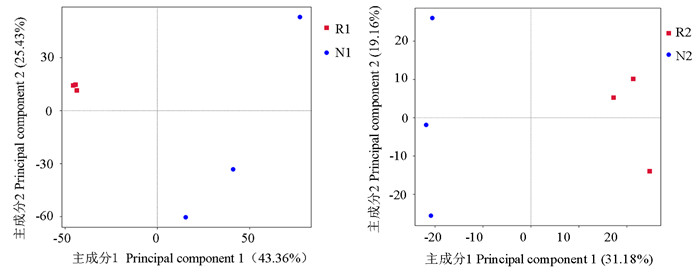
|
图 6 加拿大一枝黄花根际土壤和非根际土壤细菌和真菌群落结构组成的PCA分析 Fig.6 Principal component analysis of microbial community structure in rhizosphere soil and non-rhizosphere soil of S. canadensis |
本研究表明,加拿大一枝黄花根际土壤含水量和有机质含量显著高于非根际土壤,而pH值低于非根际土壤,这与梁雷等(2016)研究发现的加拿大一枝黄花入侵能够显著降低土壤pH值结果一致。在加拿大一枝黄花入侵对土壤有机质含量影响方面,本研究结果发现,加拿大一枝黄花入侵增加了土壤有机质,与陆建忠等(2005)研究的加拿大一枝黄花入侵增加了有机质库相一致。加拿大一枝黄花根际土壤和非根际土壤微生物多样性和丰富度都存在着一些差距,其中根际土壤细菌的多样性高于非根际土壤,丰富度则低于非根际土壤,而两者真菌的多样性和丰富度差异情况与细菌刚好相反。陈晨等(2009)研究表明,加拿大一枝黄花根际微生物多样性随着入侵时间的延长而增加。周振荣(2010)研究也发现,加拿大一枝黄花根部土壤微生物的生物量显著高于周围土壤,对细菌和放线菌有促进作用,他们的研究结果均与本研究结果有类似之处。
此外,本研究结果还表明,加拿大一枝黄花长期生长对土壤中微生物群落结构也产生了一定影响,具体表现在根际土壤和非根际土壤中细菌和真菌的物种组成及其相对丰度的不同。加拿大一枝黄花根际土壤优势细菌主要属于变形菌门,优势真菌主要属于子囊菌门、担子菌门和被孢霉门,而非根际优势细菌主要属于酸杆菌门,优势真菌主要属于子囊菌门、担子菌门和球囊菌门。付伟(2017)在不同入侵程度下加拿大一枝黄花根际细菌群落结构和功能差异的研究中也证实了加拿大一枝黄花根际细菌群落中,变形菌门的丰度是最高的,与本研究的结果类似。
外来植物在入侵过程中能够使入侵地的土壤微生物多样性和群落结构及功能发生变化,从而增强对环境的适应能力,有利于自身的入侵和生长(Tebeest et al., 2009)。而土壤微生物的改变同样也反作用于土壤环境,通过改变土壤的理化性质和物理特性,更适合入侵植物的定殖和扩张(彭鑫怡等,2019)。加拿大一枝黄花的入侵极大程度上依赖于根际有益微生物,这与其竞争能力也息息相关(Dela et al., 2006)。Dong et al.(2015)研究发现,培育加拿大一枝黄花的土壤中,真菌、需氧细菌和真菌/细菌比率随着土壤培养时间的增加显著降低,而厌氧菌和革兰氏阴性/阳性细菌比率随土壤培养时间增加而显著增加。沈荔花(2007)研究发现,加拿大一枝黄花对根际土壤真菌的数量有抑制效应,对根际土壤反硝化细菌、反硫化细菌和嫌气性纤维素分解菌的数量有抑制作用,但对亚硝酸细菌、硫化细菌和好气性自生固氮菌的数量均有促进作用。由此可知,加拿大一枝黄花的根系活动对根际微生物多样性、丰富度和群落结构有一定的调节作用,但具体的调节机制尚不明确。加拿大一枝黄花通过根系分泌次生代谢物调节土壤的理化性质,改变土壤内部营养循环,进而影响着土壤微生物的种类和数量及其分布,说明根系分泌物是加拿大一枝黄花与土壤微生物之间的重要枢纽之一(郭水良,2005;李国庆,2009;袁仁文等,2020)。本研究测定了加拿大一枝黄花根际和非根际土壤细菌和真菌的多样性、丰富度和群落组成结构及相对丰度,分析了加拿大一枝黄花根际和非根际微生物群落之间的差异,但尚未明晰该入侵植物调整根际微生物群落的方式和后果,优势细菌和真菌的区别在两者错综复杂的关系中具体起到了怎样的作用。因此,关于加拿大一枝黄花入侵后,产生变化的微生物物种在这个过程中的功能和作用还需要进一步研究。
陈晨, 傅盈盈, 黄璐, 王云菁, 何小丽, 肖明. 2009. 上海崇明东滩加拿大一枝黄花根际部分可培养细菌的多样性分析. 上海师范大学学报(自然科学版), 38(5): 516-521. DOI:10.3969/j.issn.1000-5137.2009.05.015 |
程丹丹, 赵菁, 田忠赛. 2019. 入侵植物小蓬草的细菌群落组成和多样性研究. 安全与环境工程, 26(2): 16-24. |
付伟, 2017. 不同入侵程度下加拿大一枝黄花根际细菌群落结构和功能差异. 硕士学位论文. 镇江: 江苏大学.
|
管铭, 潘小翠, 张崇邦, 王江. 2015. 外来植物入侵的微生物生态学研究进展. 浙江大学学报(理学版), 42(4): 445-452. |
郭水良. 2005. 加拿大一枝黄花的生态位及其入侵对植物群落的影响. 生物数学学报, 20(1): 91-96. DOI:10.3969/j.issn.1001-9626.2005.01.017 |
何锦峰. 2008. 外来植物入侵机制研究进展与展望. 应用与环境生物学报, 14(6): 863-870. |
侯乾, 2020. 连作马铃薯全生育期根际微生物多样性研究及施肥对其的影响. 硕士学位论文. 北京: 中国农业科学院.
|
黄芳芳, 李勤, 黄建安. 2020. 茶树根际微生物研究进展. 茶叶科学, 40(6): 715-723. DOI:10.3969/j.issn.1000-369X.2020.06.002 |
李国庆, 2009. 入侵植物加拿大一枝黄花对根际土壤微生物群落多样性的影响研究. 硕士学位论文. 福州: 福建农林大学.
|
李立青, 张明生, 梁作盼, 肖博, 万方浩, 刘万学. 2016. 丛枝菌根真菌促进入侵植物紫茎泽兰的生长和对本地植物竞争效应. 生态学杂志, 35(1): 79-86. |
梁雷, 叶小齐, 吴明, 邵学新, 李长明. 2016. 加拿大一枝黄花入侵对杭州湾湿地围垦区土壤养分及活性有机碳组分的影响. 土壤, 48(4): 680-685. |
柳旭, 孔令杰, 杨康, 韩月龙, 张风娟. 2019. 紫茎泽兰不同入侵区域土壤细菌群落多样性比较研究. 生物安全学报, 28(1): 49-58. |
鲁如坤. 2000. 土壤农业化学分析方法. 北京: 中国农业科技出版社.
|
陆建忠, 裘伟, 陈家宽, 李博. 2005. 入侵种加拿大一枝黄花对土壤特性的影响. 生物多样性, 13(4): 347-356. DOI:10.3321/j.issn:1005-0094.2005.04.008 |
彭鑫怡, 李永春, 王秀玲, 李永夫, 陈志豪, 徐秋芳. 2019. 植物入侵对土壤微生物的影响. 浙江农林大学学报, 36(5): 1019-1027. |
祁珊珊, 贺芙蓉, 汪晶晶, 李琴, 戴志聪, 杜道林. 2020. 丛枝菌根真菌对入侵植物南美蟛蜞菊生长及竞争力的影响. 微生物学通报, 47(11): 3801-3810. |
上海科学院. 1999. 上海植物志. 上海: 上海科学技术文献出版社.
|
沈荔花, 2007. 外来植物加拿大一枝黄花(Solidago canadensis L. )入侵的化感作用机制研究. 博士学位论文. 福州: 福建农林大学.
|
孙建茹, 陈雪, 桑晓玲, 蒙彦良, 贾月月, 张风娟. 2019. 入侵豚草与本地植物竞争对丛枝菌根真菌多样性的影响. 菌物学报, 38(11): 1918-1929. |
王桔红, 张丽娜, 陈学林, 陈文. 2016. 入侵植物对根际土壤微生物群落影响的研究进展. 生态科学, 35(6): 204-210. |
王志勇, 方治伟, 江雪飞, 郑慧, 袁继红. 2013. 空心莲子草入侵对土壤AM真菌生物量和群落结构的影响: 以湖北省典型区域为例. 应用与环境生物学报, 19(1): 105-112. |
许光耀, 李洪远, 莫训强, 杨军中. 2018. 入侵植物生态效应及其影响因素研究进展. 安全与环境学报, 18(1): 375-380. |
袁仁文, 刘琳, 张蕊, 范淑英. 2020. 土壤根际分泌物与土壤微生物互作关系的机制研究进展. 中国农学通报, 36(2): 26-35. |
张玉曼, 王月, 李乔, 张风娟, 万方浩. 2015. AM真菌影响入侵植物黄顶菊与本土物种狗尾草竞争生长的机理研究. 西北植物学报, 35(6): 1215-1221. |
赵晓红, 杨殿林, 曲波, 王慧, 刘红梅, 赖欣, 皇甫超河. 2014. 黄顶菊入侵对土壤氨氧化细菌群落结构及多样性的影响. 生态学杂志, 33(6): 1492-1500. |
郑洁, 刘金福, 吴则焰, 洪伟, 何中声, 蓝亦琦, 刘思迪. 2017. 闽江河口红树林土壤微生物群落对互花米草入侵的响应. 生态学报, 37(21): 7293-7303. |
中国科学院南京土壤研究所. 1978. 土壤理化分析. 上海: 上海科学技术出版社.
|
周天阳, 高景, 王金牛, 孙建, 徐波, 薛晶月, 贺俊东, 谢雨, 吴彦. 2018. 基于群落结构及土壤理化性质对围封7年青藏高原东南缘高山草地的综合评价. 草业学报, 27(12): 1-11. DOI:10.11686/cyxb2018084 |
周振荣, 2010. 外来入侵植物加拿大一枝黄花对根际土壤微环境的影响研究. 硕士学位论文. 南京: 南京农业大学.
|
DAVIS M A, GRIME J P, THOMPSON K. 2000. Fluctuating resources in plant communities: a general theory of invasibility. Journal of Ecology, 88(3): 528-534. DOI:10.1046/j.1365-2745.2000.00473.x |
DELA P E, RODRIGUEZ E S, VAN DER PUTTEN W H, FREITAS H, MOENS M. 2006. Mechanism of control of root-feeding nematodes by mycorrhizal fungi in the dune grass Ammophila arenaria. New Phytologist, 169(4): 829-840. DOI:10.1111/j.1469-8137.2005.01602.x |
DONG L J, SUN Z K, GAO Y, WEI M H. 2015. Two-year interactions between invasive Solidago canadensis and soil decrease its subsequent growth and competitive ability. Journal of Plant Ecology, 8(6): 617-622. |
KENNEDY T A, NAEEM S, HOWE K M, KNOPS J M H, TILMAN D, REICH P. 2002. Biodiversity as a barrier to ecological invasion. Nature, 417: 636-638. DOI:10.1038/nature00776 |
SHEA K, CHESSON P. 2002. Community ecology theory as a framework for biological invasions. Trends in Ecology & Evolution, 17(4): 170-176. |
TEBEEST M, STEVENS N, OLFF H, VAN DER PUTTEN W H. 2009. Plant-soil feedback induces shifts in biomass allocation in the invasive plant Chromolaena odorata. Journal of Ecology, 97(6): 1281-1290. DOI:10.1111/j.1365-2745.2009.01574.x |
WOLFE L M. 2002. Why alien invaders succeed: support for the escape-from-enemy hypothesis. The American Naturalist, 160(6): 705-711. DOI:10.1086/343872 |
ZHANG Z J, LIU Y J, BRUNEL C, KLEUNEN M V. 2020. Soil-microorganism-mediated invasional meltdown in plants. Nature Ecology & Evolution, 4(12): 1612-1621. |
 2021,Vol. 30
2021,Vol. 30


